Anvisa aprova uso da vacina CoronaVac para crianças e adolescentes
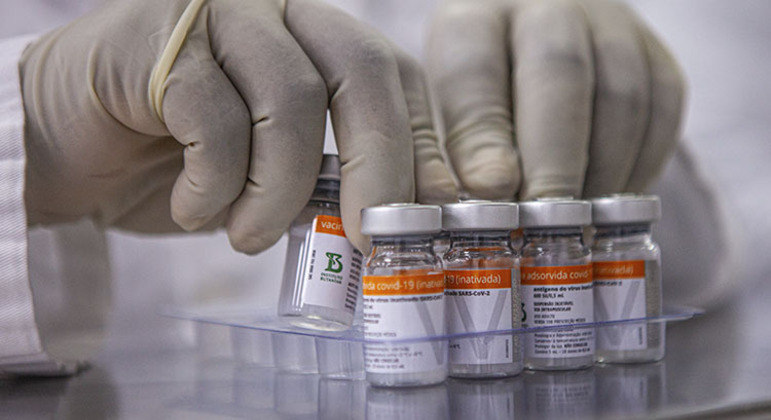
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou o uso da CoronaVac para crianças e adolescentes de 6 a 17 anos. O pedido do Instituto Butantan pleiteava o uso a partir dos 3 anos, mas a reguladora limitou a extensão tendo como base os resultados preliminares dos estudos clínicos apresentados para nortear a autorização.
A decisão foi unânime, tomada pela diretoria colegiada da reguladora, visto que a vacina não possui registro definitivo, cabendo aos diretores deliberarem sobre o tema. A indicação da Anvisa prevê que a dose para crianças seja a mesma destinada a adultos: 600 SU do antígeno do vírus inativado em 0,5 ml. O intervalo entre as aplicações deverá ser entre 2 a 4 semanas.
A autorização vem pouco mais de um mês após o segundo pedido, feito em 15 de dezembro de 2021 pelo Instituto Butantan, responsável pela CoronaVac. O primeiro processo foi apresentado em julho de 2021 e, em agosto, a agência decidiu por não aprovar a extensão do uso da vacina, considerando que, à época, não havia dados suficientes para sustentar o aval da reguladora. V
A relatora do processo, diretora Meiruze Freitas, destacou as condições críticas referentes ao cenário pandêmico mundial, com o surgimento das variantes e as potencialidades. “Aprovar o uso de mais uma vacina pediátrica é ampliar o direito do acesso ao imunobiológico que tem como finalidade proteger a saúde, em especial em um momento em que há aumento de transmissão pela variante Ômicron.”
No voto, a relatora disse estar guiada pela ciência e pelos dados. “Concluo que os benefícios conhecidos da CoronaVac superam seus riscos para ampliar a aplicação da vacina em crianças com 6 anos ou mais e em adolescente de até 17 anos, desde que tais grupos não sejam imunossuprimidos”, votou.
Somente com a apresentação de dados de estudos de fase 3 é que a Anvisa pretende poder ampliar a faixa etária contemplada com a CoronaVac, ponderou Meiruze. “A chave para proteger as crianças que não são elegíveis à vacinação é garantir que todos ao seu redor sejam vacinados e reforçados”, alertou a diretora.
Para nortear os votos, os diretores também contaram com análise das áreas técnicas da Anvisa, além do parecer dos especialistas que acompanharam as reuniões da agência junto ao Instituto Butantan, responsável pela vacina no Brasil. De acordo com a Gerência-Geral de Medicamentos e Produtos Biológicos (GGMED) e a Gerência de Farmacovigilância (GFARM) a aplicação da vacina em crianças é benéfica e segura. Mas partiu das gerências a recomendação de disponibilizar a aplicação apenas a partir dos 6 anos.
A orientação tem como base os dados fornecidos pelo estudo chileno, novidade principal que permitiu a análise favorável, mas que só apresentou resultados preliminares no público de 6 a 17 anos. As pesquisas feitas pelo governo do Chile foram apresentadas pelo Butantan no último encontro. O levantamento comparou resultados entre população pediátrica vacinada com CoronaVac e com a Pfizer e a não vacinada.
Durante o encontro, as partes interessadas também firmaram compromissos que valerão a partir da aprovação da vacina para o público infantojuvenil, como garantir doses de qualidade, acompanhar o processo vacinal e atualizar a Anvisa em caso de qualquer nova constatação. “É condição necessária que essa vacina seja objeto de estudo [transversal de imunogenicidade, efetividade e reatogenicidade] e que o Instituto Butantan fomente e acompanhe esse tipo de monitoramento, a fim de gerar dados que possam apoiar a verificação da eficácia, efetividade da vacina frente à circulação da variante Ômicron”, destacou Meiruze, durante o voto.
Para que a extensão do uso da CoronaVac passe a valer, é necessário que o Ministério da Saúde inclua o público no PNO (Plano Nacional de Operacionalização da Vacinação contra Covid-19). Em entrevista, o ministro Marcelo Queiroga já sinalizou a intenção de adquirir mais doses para esse fim, mas com a necessidade de uma avaliação por parte da equipe técnica da pasta.
“Uma vez havendo a aprovação da Anvisa, como de costume, o ministério vai analisar o inteiro teor dessa aprovação para que essa ou qualquer outra vacina que seja aprovada para qualquer faixa etária seja disponibilizada para a população brasileira. É o procedimento padrão”, disse, na segunda-feira (17). (Com informações do Portal R7).